三阴性乳腺癌(TNBC)是最具侵袭性的乳腺癌类型之一,临床上手术和化疗为主要治疗手段,化疗不能特异性靶向肿瘤,临床副作用多,疾病复发率高,亟待开发靶向性高、低毒高效的治疗药物。无机纳米颗粒已广泛应用于诊断、成像和/或治疗,磁性Fe3O4因其稳定性好、生物相容性高、安全性和磁靶向性而备受关注。
上海交通大学医学院附属新华医院临床药学部刘艳主任药师联合上海理工大学材料与化学学院李翔教授共同报道了一种基于Fe3O4涡旋纳米棒的磁性纳米药物治疗三阴性乳腺癌,相关成果以“Simultaneous Delivery of Doxorubicin and EZH2-Targeting siRNA by Vortex Magnetic Nanorods Synergistically Improved Anti-Tumor Efficacy in Triple-Negative Breast Cancer”为题于2023年6月发表于《Small》(中科院Top I区,影响因子13.3),并且选为封面文章。
该纳米棒是Fe3O4涡旋纳米棒,同时递送抗肿瘤药物DOX和基因药物EZH2 siRNA,并用巨噬细胞细胞膜(CM)包裹颗粒,命名为DOX-EZH2si-VMR@CM。该纳米药物通过化疗和基因治疗来提高TNBC的抗肿瘤功效。新华医院乳腺外科陆云姝副主任医师、新华医院临床药学部顾芬芬主管药师、新华医院马雨薇医师和上海理工大学材料与化学学院硕士生李若男为共同第一作者。
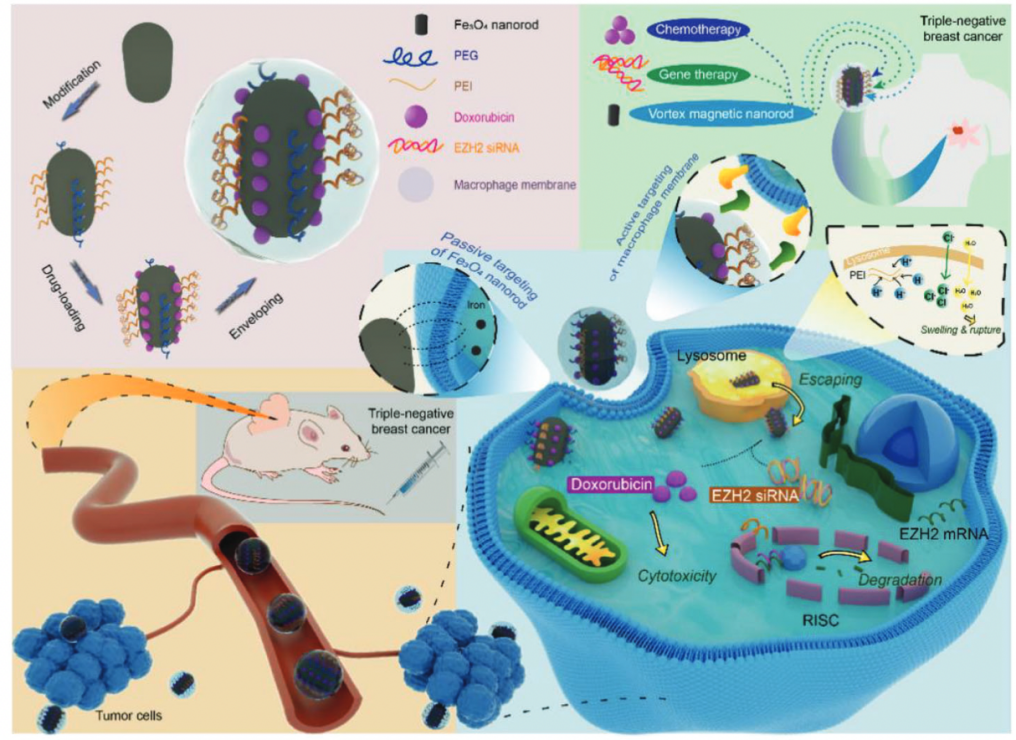
图1 靶向三阴性乳腺癌的新型纳米药物的合成和功能模型
图1示意图显示了药物递送的过程,通过被动和主动靶向肿瘤细胞,通过DOX化疗和EZH2 siRNA基因治疗进行协同治疗。涡旋磁纳米棒中独特的磁畴结构使其更好的细胞穿透和载药能力,更高的饱和磁化强度和更灵敏的磁响应,这使得它们能够以非常小的磁场强度或癌细胞产生的富含铁的环境靶向至治疗区。
DOX-EZH2si-VMR@CM的制备过程
使用水热方法合成了Fe3O4纳米棒,然后分别通过PEG上的羟基与铁离子的配位和带正电荷的PEI的静电相互作用,将Fe3O4纳米棒与PEG和PEI共轭。通过范德华力将EZH2 siRNA加载到纳米棒上,并通过PEI的静电吸附将EZH2 siRNA加载到纳米棒上,最后将所得纳米颗粒涂有巨噬细胞细胞膜CM,以产生最终的纳米药物DOX-EZH2si-VMR@CM。
TEM显示纳米药物分散良好、形状均匀,平均直径为80 nm,高度为250nm,高分辨率TEM(HRTEM)显示了Fe3O4纳米棒的晶格特征;VSM显示,Fe3O4纳米棒的饱和磁化强度Ms为94.7 emu/g,而VMR纳米棒的饱和磁化强度Ms在PEG-PEI共轭后略有下降至87.5 emu/g,VMR-PEG-PEI仍保持了高饱和磁化强度。这些结果都证明了VMR纳米棒的成功合成和共轭。DOX的负载能力随着输入浓度的增加而增加。测量了最佳剂量下DOX的体外释放曲线,证明了DOX和EZH2 siRNA成功装载到VMR纳米棒和巨噬细胞膜涂层上。
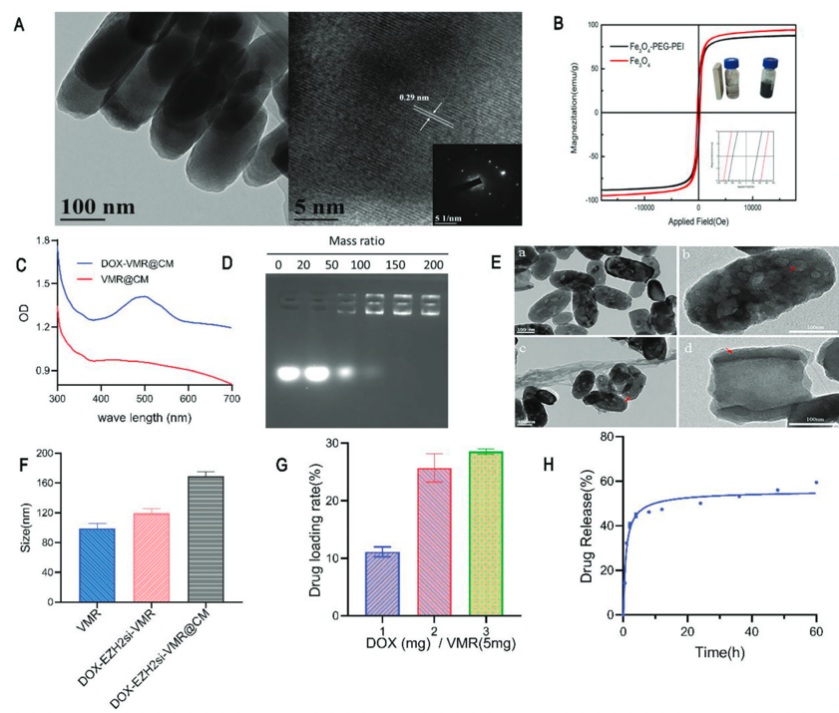
图2 涡旋磁纳米棒的制备和表征
荧光成像结果表明纳米药物有效地将有效载荷输送到癌细胞中,实现高递送效率和渗透作用。EZH2的蛋白质印迹EZH2Si-VMR@CM和DOX-EZH2siVMR@CM治疗组中的EZH2表达显著降低,表明纳米递送系统能够有效地将这两种类型的抗肿瘤药物递送到癌细胞中。
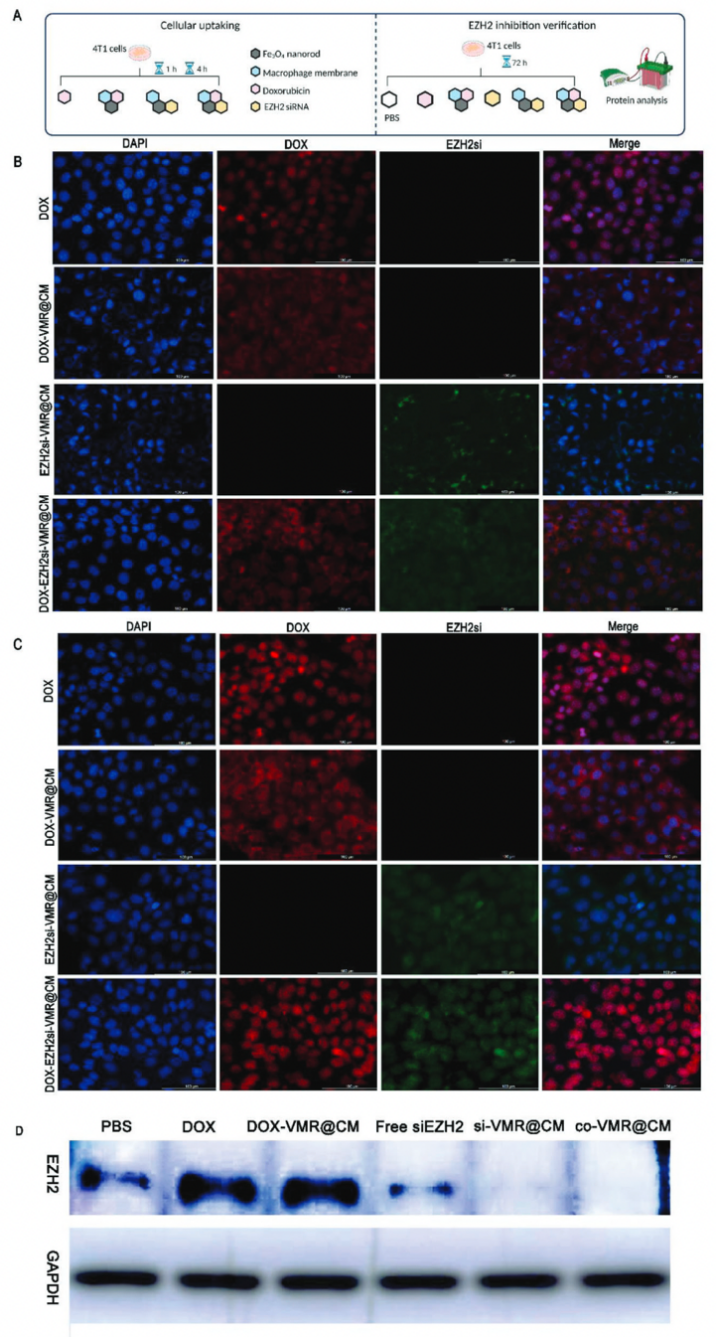
图3 细胞摄取和EZH2抑制验证的实验程序和结果
体外细胞实验显示DOX-VMR@CM组或DOX-EZH2si-VMR@CM组的纳米棒在1μgml-1下都诱导超过50%的4T1细胞凋亡,这表明了纳米载体出色的肿瘤细胞毒性。为评价化疗和基因治疗的协同作用研究者计算了协同指数,结果在0.6和0.8之间,表明DOX和EZH2 siRNA显示出与VMR递送系统的中等协同功效。
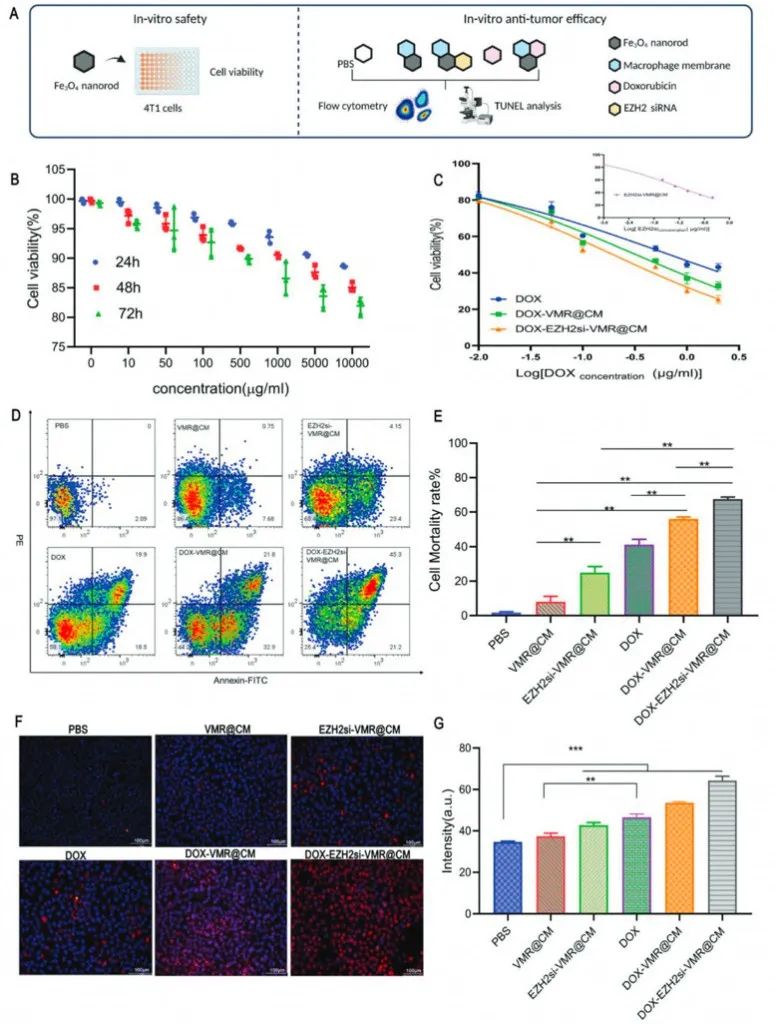
图4 药物安全性和抗肿瘤疗效的实验程序和体外实验结果
接着在体内动物实验中验证了负载DOX和EZH2-siRNA的纳米颗粒优异的生物安全性,以及涂有巨噬细胞膜的纳米棒提高了在肿瘤处的递送效率,同时减少了向肿瘤外正常组织的扩散。
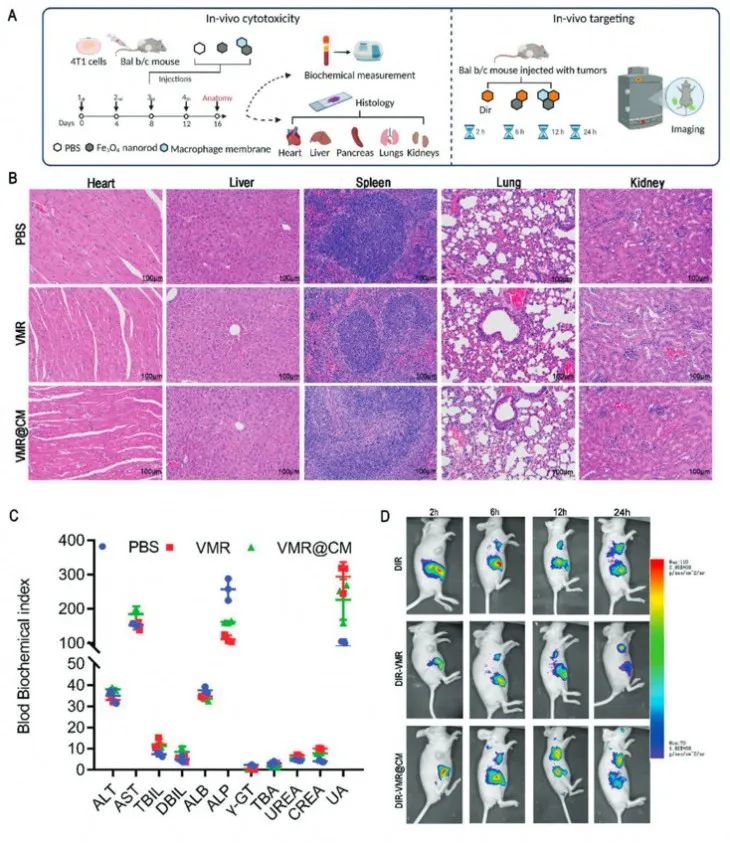
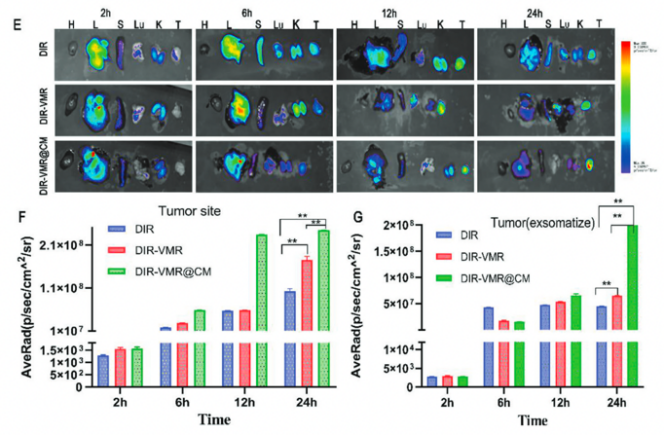
图5 纳米载体细胞毒性和靶向性能的实验程序和体内分析结果
最后进一步评估了纳米药物的抗肿瘤疗效与安全性,在小鼠模型中进行对比观察。与单独的DOX组相比,携带DOX和EZH2 siRNA的纳米颗粒显示出协同的抗肿瘤功效和低的全身毒性,因此显示出有希望的临床治疗潜力。
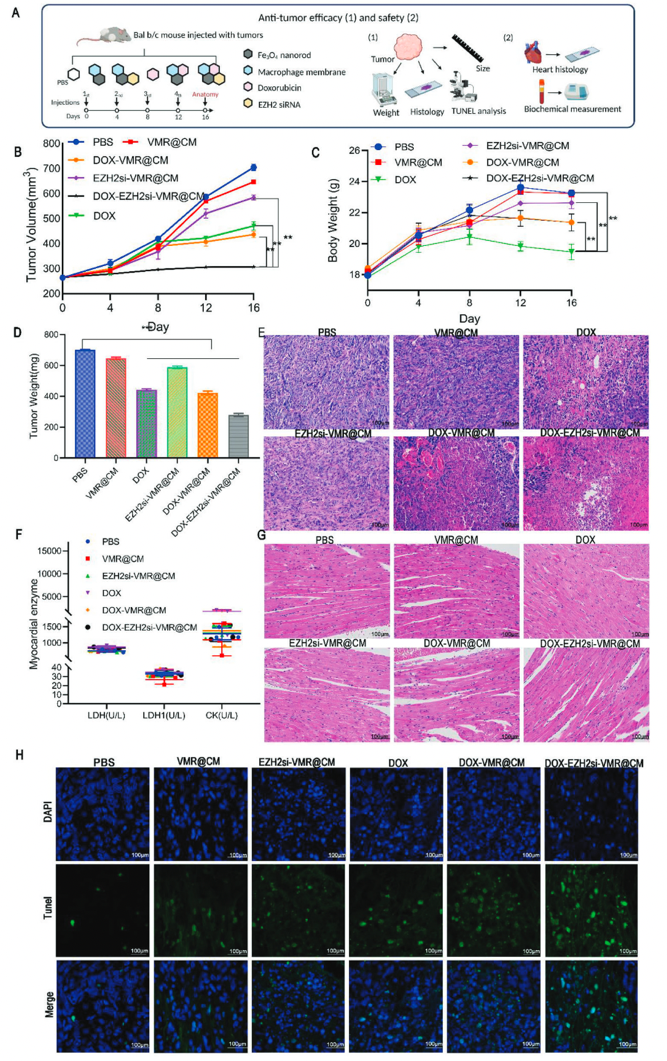
图6 抗肿瘤疗效和药物安全性的实验程序和体内分析结果
综上,该研究制备的Fe3O4涡旋磁纳米棒具有独特的磁畴结构,饱和磁化强度更高和磁响应性更灵敏,不添加外源磁场,纳米药物也能够实现靶向性。纳米棒表面包裹的巨噬细胞膜有助于免疫逃逸,延长载体在体内的循环时间,纳米颗粒也可抑制细胞膜的波动,具有较高的载药量。这种新型纳米药物载体表现出优异的组织渗透和肿瘤内积聚,肿瘤微环境中表现出高药物递送效率。DOX和EZH2 siRNA的组合具有协同性,能够显著提高了抗肿瘤疗效。将化疗和基因治疗结合成一种携带DOX和EZH2 siRNA的新型磁性纳米药物载体,在TNBC治疗中具有临床应用潜力。
通讯作者介绍:

刘艳,博士,主任药师,硕士生导师,就职于上海交通大学医学院附属新华医院临床药学部。主要研究方向为肿瘤耐药机制研究与临床转化。任中国药理学会临床药理专业委员会委员、中国毒理学会临床毒理专业委员、中国心胸麻醉协会第一届委员、上海市医学会临床药学分会青年委员等学术任职, American Journal of Health-System Pharmacy 中文版编委。承担国家自然基金、上海市教委、上海市科委等多项课题;发表国内外论文30余篇,第一/通讯发表SCI论文十余篇;申请发明专利10余项,获授权4项,第一发明人获得34届上海市优秀发明金奖。以主要参与人成果获高等学校科研优秀成果奖(科学技术)二等奖、上海市医学科技奖三等奖、上海市药学科技奖三等等。获中华医学会临床药学分会优秀临床药师、上海市药学会优秀青年药师、上海交通大学SMC-晨星青年教辅管理人员奖励计划等多项荣誉称号。

李翔,教授,博士生导师,就职于上海理工大学材料与化学学院。主要从事新型磁性材料研发及应用探索、生物医用纳米材料及器件的开发应用方面的研究,研究领域聚焦在涡旋磁纳米材料、递送化疗靶向药物载体及生物医疗器械的研发。在Advanced Science、Nano letters、Small、Chemical Engineering Journal、Carbon、Applied Physics Letters等SCI期刊上发表论文60余篇。主持国家自然科学基金面上项目、上海市教委、上海市科委及相关横向项目等10余项,获得中国专利授权10余项。兼任上海市有色金属学会理事、上海机械工程学会粉末冶金管委会委员、全国材料与器件科学家智库-专家委员会委员。担任SCI期刊《Metals》客座编辑、EI期刊“International Journal of Corrosion”编委、《当代化工研究》期刊编委。
来源:Engineerin gFor Life
链接:上海交大新华医院刘艳/上理工李翔团队《Small》:涡旋磁纳米棒递送阿霉素和EZH2siRNA协同提高TNBC的抗肿瘤疗效





